L’objectif global de notre équipe est de comprendre, dans le contexte de la différenciation et de la maturation musculaire (fibres musculaires squelettiques ou cellules cardiaques), les mécanismes de réarrangements des cytosquelettes contrôlant l’expression du génome et donc le destin des cellules musculaires. Ils se concentrent particulièrement sur le rôle de l’interactome du réseau de microtubules avec son lien sur (i) le positionnement & la forme du noyau dans les cellules musculaires et sur (ii) le contrôle de l’activité transcriptionnelle des noyaux musculaires. La fonction du tissu musculaire squelettique repose sur le maintien et la régénération des myofibres grâce à un processus finement régulé. Il commence par l’activation de cellules souches musculaires, dans lesquelles, le cil (structure microtubulaire) joue une rôle clef.
Une deuxième thématique de notre équipe vise à déchiffrer les implications des mutations nouvellement identifiées dans les gènes associés à l’architecture des noyaux ou à des composants du cytosquelette dans les maladies cardiaques (arythmie, cardiomyopathies hypertrophiques héréditaires (HCM) et cardiomyopathies dilatées (DCM)). Son équipe utilise des cultures de cardiomyocytes dérivés de cellules hiPS (directement de patients et/ou de cellules WT-hiPS où les mutations sont éditées à l’aide de la technologie CRISPR-Cas9) pour identifier l’implication fonctionnelle de mutations pathologiques putatives, en se concentrant sur les anomalies de contractilité, les troubles du cytosquelette et de la transcription.

L’ÉQUIPE
- Vincent GACHE
CRCN INSERM, HDR - Caroline BRUN
CRCN INSERM - Carole KRETZ-REMY
PU UCBL1, HDR - Gaelle BONCOMPAIN
DR CNRS, HDR - Fanny STORCK
PU VetAgroSup, HDR - Justine GUGUIN
Post-doctorant (ANR & FRM) - Vincent LOREAU
Post-doctorant (France 2030) - Lea CASTELLANO
PhD student (ED-BMIC-UCBL1) - Vanessa DEL VITO
PhD student (HCL) - Marine DAURA
PhD student (ANR) - Tanushri DARGAR
PhD student (VetAgroSup) - Anna RAUSH DE TRAUBENBERG
PhD student (ANR) - Damien CAILLOL
PhD student (AFM) - Emilie CHRISTIN
AI UCBL1 - Ludivine ROTARD
PhD student (ED-BMIC-UCBL1) - Marie ABITBOL
PU VetAgroSup, HDR - Pauline GODDARD
Ingénieure d’étude - Philippe CHEVALIER
PU-PH UCBL, HDR - Alexandre JANIN
MCU-PH UCBL - Gilles MILLAT
MCU-PH UCBL - Justine VIGNON
Master 2 - Catarina PLACIDO DA ROCHA
Master 2 - Justin ROUVIERE
Master 1 - Agathe LEDDET
Master 1
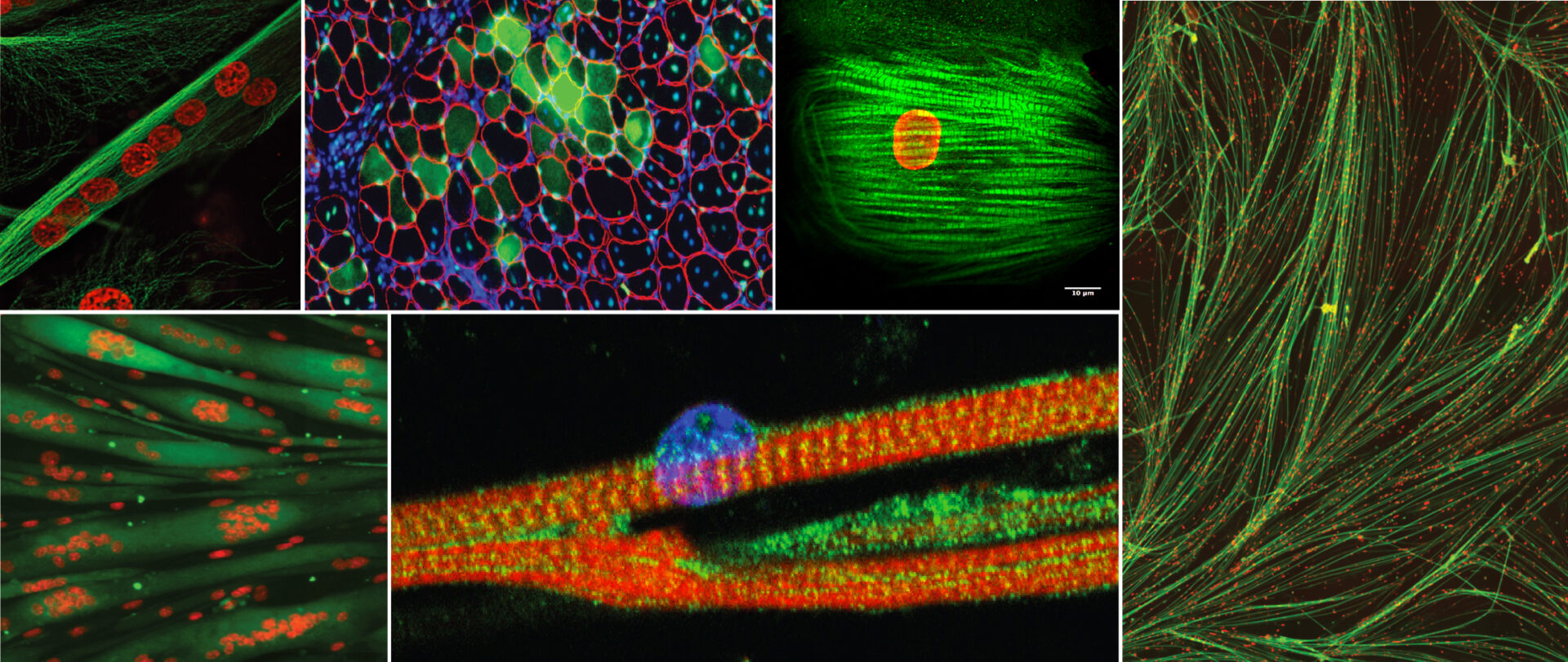
PROJETS
Évolution du protéome microtubulaire et son implication dans la formation et maintien des domaines nucléaires (MNDs) au cours du développement des muscles squelettiques (Leader: Dr. Vincent Gache)
Les noyaux se positionnent activement tout au long du développement musculaire. De nombreuses données supportent une connexion directe entre la régulation des domaines nucléaires, le maintien de l’architecture microtubulaire dans les fibres musculaires et le fonctionnement normal des muscles. Le réseau de microtubules est entièrement restructuré pendant la formation musculaire. Nous avons émis l’hypothèse que les différences entre le protéome associé aux microtubules dans les fibres immatures et matures contribuent à (1) la réorganisation des microtubules et (2) la localisation des noyaux. Nous avons développé une stratégie pour isoler et analyser ces deux protéomes en utilisant un système in vitro original qui permet la formation de fibres musculaires «matures» pures. Cette stratégie à conduit à la sélection de près de 500 candidats que nous étudions actuellement en utilisant une approche par criblage siRNA en utilisant des cellules musculaires murines/humaines primaires.
Déchiffrer les voies de signalisation régulées par le cil primaire dans les cellules souches musculaires (Leader: Dr. Caroline Brun)
La fonction du tissu musculaire squelettique repose sur le maintien et la régénération des myofibres grâce à un processus finement régulé. Il commence par l’activation de cellules souches musculaires (MuSCs) normalement quiescentes et se poursuit par la prolifération des MuSCs qui se différencient pour réparer les fibres lésées ou s’auto-renouvellent et retournent en quiescence pour restaurer leur stock. La perte de fonction des MuSCs entraîne inévitablement des troubles musculaires, tels que les maladies neuromusculaires, équivalant à une mauvaise qualité de vie, une perte d’indépendance et une augmentation de la morbidité/mortalité. Ainsi, une compréhension approfondie des processus biologiques fondamentaux régulant les MuSC garantira le succès des thérapies régénératives à base de cellules souches. Nous proposons différentes approches expérimentales visant à déchiffrer les voies de signalisation régulées par le cil primaire des MuSCs dans des contextes physiologiques et dystrophiques.
Modulation de l’intégrité des muscles squelettiques en contextes sain et pathologique (Leader: Dr. Carole Kretz-Remy)
Le fonctionnement de la fibre musculaire (myofibre) est soutenu par un positionnement précis de ses organites et noyaux. La force contractile des myofibrilles est contrôlée par le système de «couplage excitation-contraction» (ECC) de la triade, lieu de l’interconnexion entre le réticulum sarcoplasmique, un réseau de réticulum endoplasmique (RE) tubulaire, et les tubules transverses (-T), formés par des invaginations radiales répétées de la membrane plasmique. Les myopathies centronucléaires (CNM) sont des troubles neuromusculaires héréditaires dont la caractéristique majeure est une localisation anormale des noyaux au centre des myofibres. Nous cherchons à identifier des voies gouvernées par la protéine SH3KBP1 et participant au contrôle du RE, du RS, des tubules-T et de l’ECC, in vitro et in vivo.
Mécanismes du trafic membranaire dans les cellules différenciées (Leader : Dr. G Boncompain)
Le transport des protéines sécrétoires est nécessaire pour remplir des fonctions cellulaires essentielles, permettant la communication entre les cellules, le maintien des tissus et des fonctions spécialisées. Les tissus différenciés présentent des besoins sécrétoires distincts, nécessitant des adaptations des voies de transport et de l’appareil de Golgi, le centre cellulaire de la sécrétion.En utilisant des modèles dérivés de cellules souches pluripotentes induites humaines (hiPSC) ainsi que des cellules primaires, nous explorons l’organisation de l’appareil de Golgi, les acteurs moléculaires et la dynamique du transport des protéines en utilisant diverses approches telles que la microscopie à fluorescence en temps réel et quantitative, l’édition du génome et la protéomique.Le transport des protéines et l’organisation intracellulaire sont également modifiés dans certaines maladies. L’étude de la modification des voies de transport des protéines et de leur dynamique dans les cellules saines et dans les cellules porteuses de mutations est donc pertinente pour progresser dans la compréhension de la pathogenèse de la maladie, mais aussi pour identifier des leviers moléculaires, ouvrant la voie à des interventions thérapeutiques.
Identification des mutations et leurs implications dans la physiopathologie des cardiomyopathies (Leader: Dr. Vincent Gache, Pr. Abitbol, Pr. Chevalier)
Les arythmies cardiaques sont des cardiomyopathies qui regroupent différents syndromes physiopathologiques tels que la fibrillation auriculaire, la tachycardie et la fibrillation ventriculaire. Le décryptage des mécanismes moléculaires impliqués dans ces cardiomyopathies permettra d’identifier des cibles thérapeutiques et de développer de nouveaux traitements. Nous menons une approche systématique qui consiste à identifier des mutations chez des patients atteints de cardiomyopathies. En utilisant des cellules iPS (cellules souches pluripotentes induites) et la technologie CRISPR/Cas9, nous développons des cardiomyocytes avec des mutations identifiées et déchiffrons l’implication in vitro des altérations génomiques sur le comportement de ces cellules.
SÉLECTION DE PUBLICATIONS
- Intrinsic Muscle Stem Cell Dysfunction Contributes to Impaired Regeneration in the mdx Mouse. Marie E. Esper, Caroline E. Brun, Alexander Y. T. Lin, Peter Feige, Marie J. Catenacci, Marie-Claude Sincennes, Morten Ritso, Michael A. Rudnicki. J Cachexia Sarcopenia Muscle. 2025. (PMID: 39723578).
- Setdb1 protects genome integrity in murine muscle stem cells to allow for regenerative myogenesis and inflammation. Pauline Garcia, William Jarassier, Caroline Brun, Lorenzo Giordani, Fany Agostini, Wai Hing Kung, Cécile Peccate, Jade Ravent, Sidy Fall, Valentin Petit, Tom H Cheung, Slimane Ait-Si-Ali, Fabien Le Grand. Dev Cell. (PMID: 38848717)
- Myonuclear domain settings by microtubules and MACF1. Ghasemizadeh A, Gache V. Med Sci (Paris). 2024. (PMID: 39555882)
- Synthetic injectable and porous hydrogels for the formation of skeletal muscle fibers: Novel perspectives for the acellular repair of substantial volumetric muscle loss. Griveau L, Bouvet M, Christin E, Paret C, Lecoq L, Radix S, Laumonier T, Sohier J, Gache V. J Tissue Eng. 2024. (PMID: 39502329)
- Simple Methods for Permanent or Transient Denervation in Mouse Sciatic Nerve Injury Models. Osseni A, Thomas JL, Ghasemizadeh A, Schaeffer L, Gache V. Bio Protoc. 2022. (PMID: 35799900).
- Design and characterization of an in vivo injectable hydrogel with effervescently generated porosity for regenerative medicine applications. Griveau L, Lafont M, le Goff H, Drouglazet C, Robbiani B, Berthier A, Sigaudo-Roussel D, Latif N, Visage CL, Gache V, Debret R, Weiss P, Sohier J. Acta Biomater. 2022. (PMID: 34843951)
- GLI3 regulates muscle stem cell entry into GAlert and self-renewal. Caroline E. Brun, Marie-Claude Sincennes, Alexander Y. T. Lin, Derek Hall, William Jarassier, Peter Feige, Fabien Le Grand & Michael A. Rudnicki. Nat. Comm 2022. (PMID: 34059674).
- MACF1 controls skeletal muscle function through the microtubule-dependent localization of extra-synaptic myonuclei and mitochondria biogenesis. Ghasemizadeh A, Christin E, Guiraud A, Couturier N, Abitbol M, Risson V, Girard E, Jagla C, Soler C, Laddada L, Sanchez C, Jaque-Fernandez FI, Jacquemond V, Thomas JL, Lanfranchi M, Courchet J, Gondin J, Schaeffer L, Gache V. Elife. 2021. (PMID: 34448452).
- Deciphering DSC2 arrhythmogenic cardiomyopathy electrical instability: From ion channels to ECG and tailored drug therapy. Moreau A, Reisqs JB, Delanoe-Ayari H, Pierre M, Janin A, Deliniere A, Bessière F, Meli AC, Charrabi A, Lafont E, Valla C, Bauer D, Morel E, Gache V, Millat G, Nissan X, Faucherre A, Jopling C, Richard S, Mejat A, Chevalier P. Clin Transl Med. 2021. (PMID: 33784018).
FUNDING
- AAP IDEMO Région AuRA (VIP) (consortium composé de NORAKER, NOVOTEC, LBTI (CNRS) et INMG-PGNM (INSERM)).
- ANR Grant (Nucytact) (Leader: Dr. Gache))
- AFM-MyoNeurALP-2 program (2022-2027): Myonuclear domains establishment and maintenance during muscle development.
-
ANR-JCJC Grant 2022 (STEMCIL) (Leader: Dr. Brun)
-
RHU Grant (SMART) 2021 (Leader: Dr. Gache)
-
ANR Grant (Atrorescue) (Leader: Dr. Kretz))
- INMG-CNMD Joint Collaborative Research Program (2020): Spatial transcriptomic identity of myonuclei in myopathies. Collaborator: Prof. Theodore J. Perkins, Ottawa
- INMG-CNMD Joint Collaborative Research Program (2020): Implication of formins during skeletal muscle formation. Collaborator: Dr. John Copeland, Ottawa
- AFM-MyoNeurALP-1 program (2018-2022): Myonuclear domains establishment and maintenance during muscle development.
- ATIP Avenir program (2015-2020): Interplay between cytoskeleton network regulation during muscle development and muscle function.
- Centre de references maladies rares (Cardiologie, Pr. Philipe Chevalier)
- ANR: Identification of injectable and haemostatic hydrogel for guiding and reconstruction of deep wounds
- ALMS: Mutations identification and implication in the physiopathology of cardiomyopathies


![]()


Addresse
Institut NeuroMyogène (INMG-PGNM)
Pathophysiology and genetics of neuron and muscle (PGNM)
MNCA Team (Muscle Nuclear & Cytoskeleton Architecture)
CNRS/UCBL1 UMR 5261 – INSERM U1315
8 avenue Rockefeller/ 1 rue Charles Jung (Livraison)
F-69373 Lyon-cedex 8
France

