Notre travail de recherche est consacré à la physiologie et la physiopathologie de la fonction musculaire squelettique. Il a pour objectif la compréhension des mécanismes impliqués dans le contrôle de l’homéostasie calcique et du couplage excitation-contraction des fibres musculaires squelettiques dans les conditions normales et pathologiques. Pour cela nous utilisons des approches de biochimie et biologie moléculaire, de transfert de gène in vitro et in vivo ainsi qu’une combinaison d’électrophysiologie et de détection de fluorescence sur cellules en culture et sur fibres musculaires isolées.
Depuis septembre 2025 l’équipe a fusionné avec le groupe de Binnaz Yalcin, experte dans la génétique des pathologies du neurodéveloppement
(https://blog.u-bourgogne.fr/yalcingroup/) et nos perspectives sont désormais orientées vers la compréhension des troubles musculaires associés à ces pathologies.

L’ÉQUIPE
- Vincent JACQUEMOND
DR CNRS, HDR - Binnaz YALCIN
DR Inserm - Bruno ALLARD
PR UCBL, HDR - Christine BERTHIER
MCU UCBL - Stephan COLLINS
MCU Univ. Bourgogne - Léa DEMESMAY-MICHAUD
POST-DOCTORANTE - Jonathan SCHREIBER
IE - Céline MALLEVAL
IE - Camille DAUVOIS
AI - Emilia SKUTUNOVA
DOCTORANTE - Xiang WU
DOCTORANT - Hanzala DAUD
Master graduate
 PROJETS
PROJETS
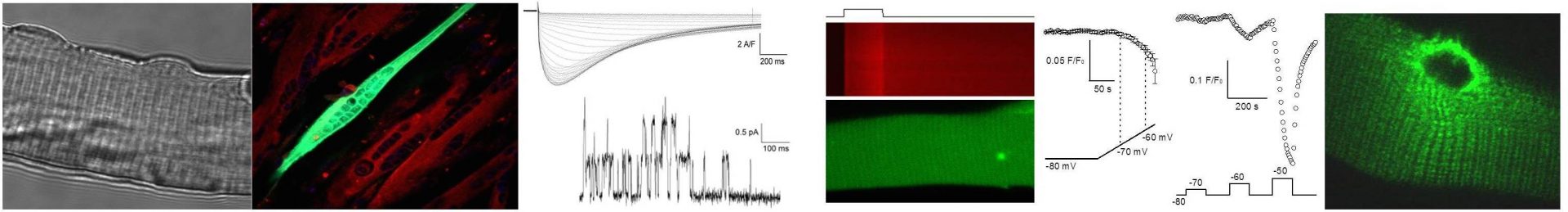
La contraction musculaire est initiée lorsque les potentiels d’action générés à la plaque motrice se propagent dans la membrane plasmique où ils déclenchent un changement de conformation du canal calcique voltage-dépendant CaV1.1. Celui-ci en retour modifie son interaction avec un autre canal calcique (le récepteur de la ryanodine de type 1, RyR1) présent dans la membrane adjacente du réticulum sarcoplasmique ce qui entraîne l’ouverture de ce canal. Les ions Ca2+ sont alors massivement extrudés de la lumière du RS vers le cytosol où ils déclenchent la contraction. Ce processus est appelé couplage excitation-contraction (EC). Par ailleurs, il existe aussi un influx de Ca2+ extracellulaire à travers la membrane plasmique. Nous avons un intérêt spécifique pour ces mécanismes qui jouent un rôle clé dans la fonction musculaire et nous dédions des efforts particuliers à appréhender leur fonction en temps réel, dans des cellules musculaires isolées intactes. Notre recherche vise à identifier le détail des propriétés fonctionnelles de ces mécanismes et comment celles-ci sont altérées dans des conditions pathologiques.
Nos objectifs principaux visent à :
1- Comprendre les mécanismes fondamentaux qui régulent la fonction de CaV1.1 et RyR1.
2- Démontrer comment l’excitabilité musculaire et/ou le couplage EC sont affectés par des mutations pathologiques affectant les gènes codant pour CaV1.1 et RyR1 et également pour d’autres protéines impliquées dans la fonction ou la maintenance de la machinerie du couplage EC.
SÉLECTION DE PUBLICATIONS
-
Reduced voltage-activated Ca2+ release flux in muscle fibers from a rat model of Duchenne dystrophy. Jonathan Schreiber, Ludivine Rotard, Yves Tourneur, Aude Lafoux, Christine Berthier, Bruno Allard, Corinne Huchet, Vincent Jacquemond. J Gen Physiol (2025). 157(2):e202413588
-
A mechano- and heat-gated two-pore domain K+ channel controls excitability in adult zebrafish skeletal muscle. Romane Idoux, Chloé Exbrayat-Héritier, Frédéric Sohm, Francisco Jaque-Fernandez, Elisabeth Vaganay, Christine Berthier, Sandrine Bretaud, Vincent Jacquemond, Florence Ruggiero, Bruno Allard. Proc Natl Acad Sci U S A (2023). 120(45):e2305959120
- Probenecid affects muscle Ca2+ homeostasis and contraction independently from pannexin channel block. Francisco Jaque-Fernandez, Bruno Allard, Laloé Monteiro, Aude Lafoux, Corinne Huchet, Enrique Jaimovich, Christine Berthier, Vincent Jacquemond. J Gen Physiol (2023) 155(4):e202213203.
- Superfast excitation–contraction coupling in adult zebrafish skeletal muscle fibers. Idoux R, Bretaud S, Berthier C, Ruggiero F, Jacquemond V, Allard B. J Gen Physiol (2022) 154 (9): e202213158.
- Lack of the myotendinous junction marker col22a1 results in posture and locomotion disabilities in zebrafish. Malbouyresa M, Guirauda A, Lefrançois C, Salamito M, Nauroy P, Bernard L, Sohm F, Allard B, Ruggiero F. Matrix Biology (2022) 109:1-18
- Mice with muscle-specific deletion of Bin1 recapitulate centronuclear myopathy and acute downregulation of dynamin 2 improves their phenotypes. Silva-Rojas R, Nattarayan V, Jaque-Fernandez F, Gomez-Oca R, Menuet A, Reiss D, Goret M, Messaddeq N, M Lionello V, Kretz C, S Cowling B, Jacquemond V, Laporte J. Molecular Therapy (2022) 30(2):868-880
- Pannexin-1 and CaV1.1 show reciprocal interaction during excitation-contraction and excitation-transcription coupling in skeletal muscle. Jaque-Fernández F, Jorquera G, Troc-Gajardo J, Pietri-Rouxel F, Gentil C, Buvinic S, Allard B, Jaimovich E, Jacquemond V, Casas M. J Gen Physiol (2021) 153(12):e202012635
- Detection of Ca2+ transients near ryanodine receptors by targeting fluorescent Ca2+ sensors to the triad. Sanchez C, Berthier C, Tourneur Y, Monteiro L, Allard B, Csernoch L, Jacquemond V. J Gen Physiol (2021) 153(4):e202012592
- In vivo RyR1 reduction in muscle triggers a core-like myopathy. Pelletier L, Petiot A, Brocard J, Giannesini B, Giovannini D, Sanchez C, Travard L, Chivet M, Beaufils M, Kutchukian C, Bendahan D, Metzger D, Franzini Armstrong C, Romero NB, Rendu J, Jacquemond V, Fauré J, Marty I. Acta Neuropathol Commun (2020) 8(1):192
- Differential physiological roles for BIN1 isoforms in skeletal muscle development, function and regeneration. Prokic I, Cowling BS, Kutchukian C, Kretz C, Tasfaout H, Gache V, Hergueux J, Wendling O, Ferry A, Toussaint A, Gavriilidis C, Nattarayan V, Koch C, Lainé J, Combe R, Tiret L, Jacquemond V, Pilot-Storck F, Laporte J. Dis Model Mech (2020) 13(11): dmm044354
- Divalent cations permeation in a Ca2+ non-conducting skeletal muscle dihydropyridine receptor mouse model. Idoux R, Fuster C, Jacquemond V, Dayal A, Grabner M, Charnet P, Allard B. Cell Calcium (2020) 91 : 102256
- Preserved Ca2+ handling and excitation-contraction coupling in muscle fibres from diet-induced obese mice. Jaque-Fernandez F, Beaulant A, Berthier C, Monteiro L, Allard B, Casas M, Rieusset J, Jacquemond V. Diabetologia (2020) 63: 2471-2481
- Molecular determinants of homo- and heteromeric interactions of Junctophilin-1 at triads in adult skeletal muscle fibers. Rossi D, Scarcella AM, Liguori E, Lorenzini S, Pierantozzi E, Kutchukian C, Jacquemond V, Messa M, De Camilli P, Sorrentino V. Proc Natl Acad Sci U S A (2019) 116(31): 15716–15724
- Unraveling the pathophysiology of Bethlem Myopathy using a unique zebrafish model for the disease.
Idoux R, Bretaud S, Berthier C, Jacquemond V, Ruggiero F, Allard B. Med Sci (2019) 35 (Hors série n° 2) : 39-42 - Mammalian skeletal muscle does not express functional voltage-gated H+ channels.
Fuster C, Idoux R, Berthier C, Jacquemond V, Allard B. Am J Physiol Cell Physiol. (2018) 315:C776-C779. - Tracking the sarcoplasmic reticulum membrane voltage in muscle with a FRET biosensor.
Sanchez C, Berthier C, Allard B, Perrot J, Bouvard C, Tsutsui H, Okamura Y, Jacquemond V. J Gen Physiol (2018) 150:1163-1177. - Na leak with gating pore properties in hypokalemic periodic paralysis V876E mutant muscle Ca channel. Fuster C, Perrot J, Berthier C, Jacquemond V, Charnet P, Allard B. J Gen Physiol (2017) 149:1139-1148.
- Impaired excitation-contraction coupling in muscle fibres from the dynamin2R465W mouse model of centronuclear myopathy. Kutchukian C, Szentesi P, Allard B, Trochet D, Beuvin M, Berthier C, Tourneur Y, Guicheney P, Csernoch L, Bitoun M, Jacquemond V. J Physiol (2017) 595:7369-7382.
- Elevated resting H+ current in the R1239H type 1 hypokalaemic periodic paralysis mutated Ca2+ channel. Fuster C, Perrot J, Berthier C, Jacquemond V, Allard B. J Physiol (2017) ;595:6417-6428.
- Phosphatidylinositol 3-kinase inhibition restores Ca2+ release defects and prolongs survival in myotubularin-deficient mice. Kutchukian C, Lo Scrudato M, Tourneur Y, Poulard K, Vignaud A, Berthier C, Allard B, Lawlor MW, Buj-Bello A, Jacquemond V. PNAS(2016) 113:14432-14437.
- Voltage-gated Ca2+ influx through L-type channels contributes to sarcoplasmic reticulum Ca2+ loading in skeletal muscle.
Robin G, Allard B. J Physiol (2015) 593:4781-4797. - Depression of voltage-activated Ca2+ release in skeletal muscle by activation of a voltage-sensing phosphatase.
Berthier C, Kutchukian C, Bouvard C, Okamura Y, Jacquemond V. J Gen Physiol (2015) 145:315-330. - Dihydropyridine receptors actively control gating of ryanodine receptors in resting mouse skeletal muscle fibres.
Robin G, Allard B. J Physiol (2012) 590:60275-6036. - Defects in Ca2+ release associated with local expression of pathological ryanodine receptors in mouse muscle fibres.
Lefebvre R, Legrand C, Gonz·lez-RodrÌguez E, Groom L, Dirksen RT, Jacquemond V. J Physiol (2011) 589:5361-5382.
FINANCEMENTS
- AFM-Téléthon / MyoNeurALP Alliance (2022-2027)
- ANR FishandCol6 (2020-2023)
- Fondation pour la Recherche Médicale
- Ligue Contre le Cancer
- CONYCIT (Conicyt Comisión Nacional de Investigación Científica y Tecnológica)
![]()



Adresse
Institut NeuroMyoGène
UCBL – CNRS UMR 5310 – INSERM U1217
Faculté de Médecine et de Pharmacie – 3ème étage – Couloir AB
8 avenue Rockefeller
69008 Lyon
France

