Talents CNRS 2024 : Karine Monier lauréate du prix Cristal !
Karine Monier réalise des développements technologiques pour démocratiser la microscopie de Super-résolution dSTORM en biologie à l’INMG-PGNM. Elle coordonne un consortium transdisciplinaire, à l’origine du tampon longue durée « Eternity », développé initialement au Laboratoire Transdiciplinaire Joliot-Curie de l’ENS de Lyon avec la contribution de Christophe Place au Laboratoire de physique de l’ENS de Lyon et d’Arnaud Favier du Laboratoire d’Ingénierie des Matériaux Polymères de Lyon.
La microscopie à reconstruction optique stochastique directe (dSTORM) est une approche de microscopie de localisation de molécules uniques (SMLM) qui permet d’atteindre des précisions de localisation de quelques dizaines de nanomètres, offrant ainsi une amélioration d’environ 10 fois par rapport à l’approche de microscopie conventionnelle classique. Cependant, l’accès au monde de la SMLM est encore semé d’embûches.
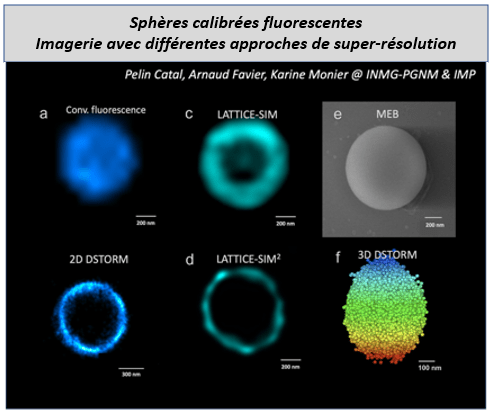
L’une d’entre elle est la courte durée de vie du tampon clignotant aqueux, nécessaire pour accéder à la localisation de molécules uniques. Pour résoudre ce problème, le consortium a mis au point un premier tampon, appelé « Eternity » (Ref 1), qui est désormais disponible commercialement sous le nom d’Everspark 1.0 et qui permet de réaliser des images pendant plusieurs semaines (au lieu de quelques heures, comme c’est le cas habituellement). Grâce à un financement de pré-maturation du CNRS (150 k€ pour 2 ans), le défi suivant auquel Karine Monier a pu s’attaquer est la limitation de la gamme de longueurs d’onde, l’imagerie dSTORM étant principalement limitée aux fluorophores émettant dans le rouge et le rouge lointain. Afin d’étendre les applications dSTORM, en particulier aux molécules fluorescentes dans le canal vert qui sont encore difficiles à imager, Karine et ses collaborateurs ont conçu avec succès de nouvelles recettes de tampon. Les performances des meilleurs candidats ont été évaluées dans le canal vert grâce à des microsphères de calibration FluoRef, qui ont été développées par le consortium et qui sont maintenant revendues par Idylle sous le nom de SphéroRuler . Ces objets de calibration 3D nous ont permis de démontrer la fiabilité de nos reconstructions 3D dSTORM dans le canal vert en comparaison au canal de référence rouge sombre avec nos nouvelles recettes de tampon par rapport au tampon original, tout en s’affranchissant de la variabilité biologique.
Pour évaluer la durée de vie des tampons, un suivi de 4 mois a été effectué sur des lames montées, préparées à l’aide de microsphères de référence fluorescentes dans le rouge lointain (FluoRef) et scellées sur des boîtes Willco à l’aide d’un outil conçu en interne avec une imprimante 3D, appelé « LaToupie ». Les niveaux d’oxygène dans la chambre ainsi que l’imagerie 3D dSTORM ont été enregistrés afin de corréler le pourcentage local en oxygène au nombre de localisation enregistrées par sphère au cours du temps.
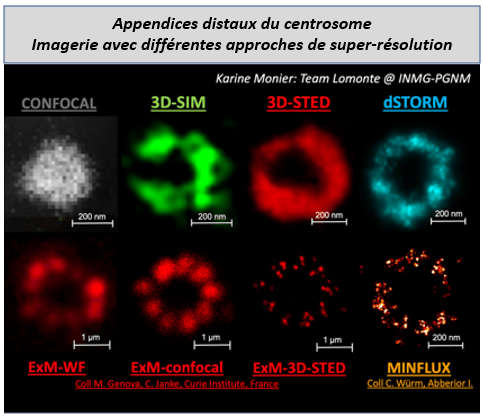
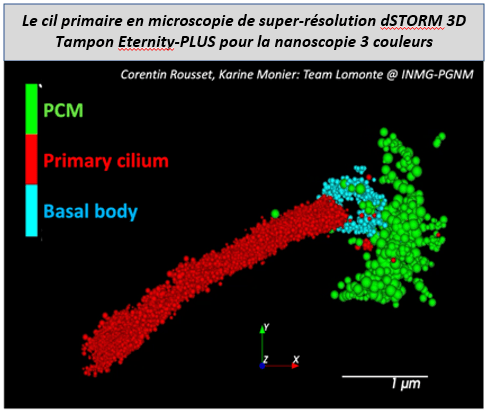
Après cette démonstration de principe, la nanoscopie dSTORM en trois couleurs, y compris le canal vert, a été appliquée à diverses structures biologiques, notamment le centrosome et le cil primaire, pour illustrer l’efficacité d’ « Eternity-PLUS », notre nouveau tampon à longue durée de vie adapté à la trichromie. L’évaluation de la distribution relative d’une protéine cible dans deux compartiments adjacents a ainsi été rendue possible. Nous l’avons notamment appliqué pour décrypter l’ultra-localisation de la nucléoline, une protéine nécessaire à la régulation du centrosome (Ref 2), à la dynamique des microtubules (Ref 3), et à la régulation du complexe d’épissage (Ref 4) ; et pour laquelle nous avons précédemment conçu une nanosonde basée sur un polymère-aptamère fluorescent (Ref 5). En outre, le dépôt de fiduciaires FluoRef multicolores sur des structures biologiques marquées permet de vérifier la qualité de la reconstruction 3D et l’alignement chromatique à proximité d’une structure biologique à explorer (Ref 6). Cet ajout de FluoRef sur des lames biologiques permet de générer des lames de référence qui seront calibrées.
Notre nouveau tampon « Eternity-PLUS » a également été validé sur des échantillons épais de fibres musculaires marquées avec 3 fluorochromes (vert, rouge et rouge-sombre) lors d’un Workshop organisé avec Céline Malleval (Equipe Gache à l’INMG) pendant la dernière édition de l’Ecole Thématique MiFoBio (Novembre 2023 à La Presqu’île de Giens). Lors de ce workshop, les microtubules, l’actinine et les mitochondries ont été imagés à l’échelle d’une 20aine de nanomètres dans des tissus épais. Notre tampon est également adapté à l’imagerie en mode spectral demixing (Ref 7 et 8) que nous avons réalisé sur des fibres musculaires, imagées avec l’équipe de Sandrine Levèque-Fort à l’ISMO à Paris.
Les outils innovants que nous développons autour de la microscopie de super-résolution dSTORM ont été mis à l’honneur récemment dans la lettre du CNRS Innovation du 22 mars 2024.
Cette nouvelle recette de tampon Eternity-PLUS (Ref 6) a été transférée au cours de l’année 2023 à la Société Idylle, qui l’a inscrite à son catalogue sous le nom de Everspark 2.0.
La valorisation des outils développés par Karine Monier et ses collègues a également ouvert la porte à la signature d’un contrat avec la Société Bruker, dont la branche en Microscopie de Fluorescence (Bruker-FM), est particulièrement friande pour organiser des démonstrations robustes afin de réaliser des démonstrations pertinentes sur le système Vutara au laboratoire INMG-PGNM. Dans ce contexte, la Société Bruker a accepté de mettre à disposition dans notre laboratoire un microscope Vutara VXL avec système de microfluidique (d’une valeur neuve de 400 k€) pour poursuivre le développement de nos projets de recherche. Ces travaux se concentreront sur l’exploitation des tampons multicouleurs à longue durée de vie et des outils de calibration pour la nanoscopie, visant au développement de lames de référence calibrées. Grâce au CNRS, cette mission a été confiée à un ingénieur en alternance de l’ESTBB, recruté pour 3 ans au laboratoire INMG-PGNM, qui bénéficie de la formation continue par le personnel Bruker. En accord avec la Société Bruker, notre VXL est également ouvert à la communauté scientifique dans le cadre de Workshops scientifiques (6 par an) pour découvrir de nouvelles fonctionnalités techniques (DNA Paint, oligo-STORM) ou thématiques (plantes, organismes modèles) atteignables en nanoscopie avec ce système de super-résolution. Ce contrat de collaboration industrielle a été validé début janvier 2024 entre la Société Bruker et le Service Partenariat et Valorisation du CNRS de la DR7.
Références :
- Provost A., Rousset C.,, Bourdon L., Mezhoud S., Reungoat E., Fourneaux C., Bresson T., Pauly M., Béard N., Possi-Tchouanlong L., Grigorov B., Bouvet P., Diaz J.J., Chamot C., Pécheur E.-I., Ladavière C. *, Charreyre M.-T. *, Favier A., Place C.*, Monier K. * (2019) Innovative particle standards and long-lived imaging for 2D and 3D dSTORM. Sci. Rep. 9(1):17967, doi: 10.1038/s41598-019-53528-0.
- Ugrinova I., Monier K., Ivaldi C., Thiry M., Storck S., Mongelard F. and Bouvet P. * (2007) Inactivation of nucleolin leads to nucleolar disruption, cell cycle arrest and defects in centrosome duplication. BMC Molecular Biology, 8:66. doi:10.1186/1471-2188-8-66
- Gaume X., Tassin A.M., Ugrinova I., Mongelard F., Monier K.*& Bouvet P.*(2015) Centrosomal nucleolin is required for microtubule network organization. Cell Cycle 14:6, 902-919, doi: 10.1080.
- Ugrinova I., Chalabi-Dchar M.,, Monier K., Bouvet P.* (2019) Nucleolin interacts and co-localizes with components of pre-catalytis spliceosome complexes. Sci 1, 33; doi:10.3390/sci1020033
- Fabre L., Rousset C., Monier K., Da Cruz-Boisson F., Bouvet P., Charreyre M-T., Delair T., Fleury E., Favier A. (2022) Fluorescent polymer-AS1411-aptamer probe for dSTORM super-resolution imaging of endogenous nucleolin, BioMacrolecules, May 12. doi: 10.1021/acs.biomac.1c01706.
- Manuscript in preparation : Green dSTORM optimized with calibration spheres and applied to centrosome and primary cilium for 3-color nanoscopy. Rousset C., Axel Fontanier A., Catal P., Danglot L., Lomonte P., Favier A., Place C., Monier K.
- Abstract : Abigail Illand A., Jouchet P., Malleval C., Gache V., Monier K., Fort E., Lévêque-Fort S. (2023) Time shifting interferences for in depth tissue imaging in single molecule localization Microscopy, Volume 122, ISSUE 3, SUPPLEMENT 1, 276a-277a, February 10, 2023, https://doi.org/10.1016/j.bpj.2022.11.1577
- Manuscript in preparation : In depth localization in tissue by spectral demixing with MODLOC. Abigail Illand A., Jouchet P., Malleval C., Gache V., Monier K., Fort E., Lévêque-Fort S. (2023)